Suite à notre dernière IP Alert du 23 janvier 2025, la décision de la Commission Européenne publiée le 8 avril 2025 (seulement en anglais) est désormais disponible sous la référence AT.40588 : https://competition-cases.ec.europa.eu/cases/AT.40588
Faits
Teva commercialise le Copaxone pour le traitement de la sclérose en plaques, notamment dans l’Espace économique européen (EEE).
Le Copaxone est depuis longtemps le plus gros succès commercial de Teva. L’agent actif du Copaxone est l’acétate de glatiramère (GA).
Tandis que son brevet de base pour le GA approche de l’expiration en 2015 et que le concurrent néerlandais Synthon se prépare à entrer sur le marché avec son produit GA (Synthon GA), Teva a conçu une stratégie élaborée et multidimensionnelle pour protéger le Copaxone de la concurrence en prolongeant son exclusivité et en empêchant ou en retardant le début d’une concurrence significative sur les prix de la part d’autres médicaments GA.
Entre le 24 et le 28 octobre 2019, des inspections inopinées selon l’Article 20(4) du Règlement 1/2003 ont été menées dans les locaux de Teva aux Pays-Bas, en Allemagne et au Royaume-Uni. Les inspections se sont poursuivies plus tard dans les locaux de la Commission et en présence de représentants de Teva. Le 4 mars 2021, la Commission a ouvert une procédure en vue d’adopter une décision en vertu du chapitre III du Règlement 1/2003.
Décision
1/ Définition du marché et position dominante (cf points 6.3.4 à 7.3) :
Dans chacun des 7 États membres étudiés (Belgique, République Tchèque, Allemagne, Italie, Pays-Bas, Pologne et Espagne – les États membres concernés ou EMC), le marché pertinent est le marché de la GA.
En effet, l’entrée (imminente) sur le marché du Synthon GA a modifié la nature de la concurrence pour le Copaxone, passant d’une concurrence non tarifaire à une concurrence tarifaire.
La décision constate que Teva détenait une position dominante dans chacun des 7 EMC, compte tenu des parts de marché conséquentes de Teva et de ses bénéfices nets importants, des barrières élevées à l’entrée et à l’expansion, de l’absence de contre-pouvoir d’achat suffisant et des documents internes de Teva faisant référence à sa position dominante et corroborant l’analyse de la Commission.
2/ Premier abus : Utilisation abusive de brevets divisionnaires (cf points 5.2.3.2 et 8 à 8.6) :
La décision conclut que Teva a commis un abus de position dominante en violation de l’Article 102 du TFUE en utilisant abusivement le système des brevets et les procédures en matière de brevets.
La conduite de Teva consistait en deux pratiques étroitement liées :
a) Premièrement, Teva a échelonné les dépôts de brevets divisionnaires à l’OEB pour deux familles de brevets dont le contenu se chevauchait largement (cf notamment point 8.3). Ces brevets partageaient des caractéristiques essentielles présentant de profondes faiblesses juridiques. Ils partageaient donc le même risque d’être révoqués en cas de contestation de validité, ce qui constitue un instrument-clé pour éliminer les brevets injustifiés.
b) Deuxièmement, Teva a fait obstruction à un examen juridique efficace de ces faiblesses par le biais de retraits stratégiques de ces brevets devant les Chambres de recours techniques de l’OEB (cf notamment point 8.3.3). Ainsi, aucune décision n’a été prononcée alors qu’un ou plusieurs brevets comportant des revendications similaires chevauchantes étaient toujours en vigueur.
Teva a ainsi empêché l’OEB de rendre une décision finale sur la validité des revendications qui se chevauchaient (donc pas de création d’un précédent).
Par conséquent, les génériqueurs n’ont eu d’autre choix que de recommencer à plusieurs reprises, de zéro, leurs contestations de validité contre les brevets restants.
3/ Deuxième abus : dénigrement par exclusion (cf points 5.2.3.5 et 9à 9.6) :
La décision conclut que Teva a mis en œuvre une campagne de dénigrement contre Synthon GA pour entraver et/ou retarder son entrée sur le marché dans chaque EMC.
En particulier, la décision constate que :
(i) Teva a diffusé des informations objectivement trompeuses sur les caractéristiques-clés du produit Synthon GA, susceptibles de le discréditer et qui allaient à l’encontre des conclusions réglementaires des agences compétentes du médicament dans l’UE : en particulier, Teva a communiqué sur des différences cliniquement non pertinentes dans les structures moléculaires du Copaxone et du Synthon GA ; Teva a souligné les risques observés dans l’utilisation d’autres substances apparentées au glatiramère, laissant entendre de manière injustifiée qu’ils s’appliquaient également au Synthon GA ; et Teva a remis en question la validité scientifique de l’étude sur laquelle les autorités compétentes ont fondé leur constat d’équivalence thérapeutique entre le Copaxone et le Synthon GA ;
(ii) Teva a mis en place des mécanismes efficaces pour diffuser des messages objectivement trompeurs aux parties concernées (autorités nationales compétentes en matière de fixation du prix et de remboursement, caisses d’assurance maladie et professionnels de santé) dans les 7 EMC ;
(iii) cette conduite était susceptible de produire des effets d’exclusion ; et
(iv) elle n’était pas objectivement justifiée.
L’affaire est disponible sous le numéro AT.40588 (https://competition-cases.ec.europa.eu/cases/AT.40588 ) mais aucune version publique de la décision n’est disponible pour l’instant en raison de secrets d’affaires/informations confidentielles. Le département Concurrence travaille actuellement à l’élaboration d’une version éditable de la décision.
Nous mettrons à jour cette communication dès que la décision sera rendue publique.
4/ Durée
La décision constate que le premier abus (utilisation abusive de brevets divisionnaires par Teva) a débuté dans tous les EMC le 3 février 2015 et s’est terminé à des dates différentes selon les EMC.
La décision constate également que le deuxième abus (campagne de dénigrement de Teva contre le Synthon GA) a débuté dans tous les EMC le 12 avril 2016 (date de l’annonce publique de l’approbation du Synthon GA) et, selon une approche conservatrice de la Commission, s’est terminé à des dates différentes selon les EMC.
Il est toutefois pertinent de noter qu’il existe des preuves que Teva a utilisé des messages dénigrants sur le Synthon GA au moins jusqu’en 2021, et que la société n’a jamais mis en œuvre de mesures correctives concernant la diffusion desdits messages.
Ces deux abus étant complémentaires et visant à protéger/renforcer la position dominante de Teva sur les marchés GA, ils constituent une infraction unique et continue et ont duré entre 3 et 9 ans selon les EMC.
5/ Amendes
Le calcul de l’amende est basé sur une valeur annuelle moyenne des ventes calculée sur l’ensemble de la période plutôt que sur la valeur des ventes réalisées au cours du dernier exercice complet de l’infraction.
(le fait de se fonder sur le chiffre d’affaires du dernier exercice complet de l’infraction sous-estimerait considérablement la valeur des ventes contestées et ne serait pas représentatif de l’importance économique de l’infraction unique et continue de Teva)
L’évaluation de la gravité de l’infraction prend en compte la nature particulièrement grave de l’infraction, le fait que Teva a commis l’infraction intentionnellement ou au moins par négligence et qu’un comportement abusif a été mis en œuvre, que Teva détenait des parts de marché élevées dans chaque EMC et que l’infraction de Teva couvrait environ 2/3 des ventes du Copaxone de Teva dans l’EEE.
La décision considère que les deux pratiques abusives sont très complémentaires et se renforcent mutuellement en se chevauchant largement dans le temps. Ainsi, un coefficient de gravité plus élevé est appliqué pour les EMC lorsque les deux pratiques étaient en cours simultanément pendant plus d’un tiers de la durée totale de l’infraction unique et continue.
Enfin, pour la République Tchèque et l’Allemagne, une majoration du coefficient de gravité est appliquée, en raison des injonctions préliminaires obtenues sur la base des brevets divisionnaires qui étaient concernés par le comportement abusif de Teva.
Afin de contribuer à l’effet dissuasif que l’amende devrait avoir sur une entreprise d’une taille et de ressources telles que Teva, la Commission a appliqué un montant supplémentaire correspondant aux valeurs des ventes pertinentes (= valeur moyenne des ventes de Copaxone x coefficient de gravité utilisé dans l’EMC).
Aucune circonstance aggravante ou atténuante n’a été appliquée.
La décision inflige une amende unique de 462 578 000 EUR à Teva, qui est calculée séparément pour chacun des EMC :
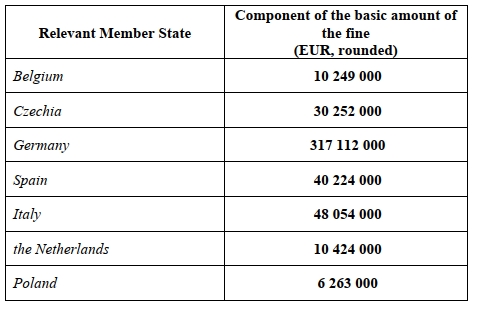
Les amendes calculées ne dépassent pas 10 % du chiffre d’affaires mondial de Teva.
C’est la première fois que la Commission impose une amende pour ces deux types de pratiques.